En quoi la radiothérapie peut- elle permettre de soigner les cancers tout en présentant des risques d’effets secondaires ?
II- Protocole radiothérapeutique et effets secondaires.
1) Caractéristiques d’une cellule cancéreuse
Chaque type de cancer est caractérisé par le type de cellule l’ayant déclenché au départ. Par conséquent, une tumeur « maligne », c’est-à-dire cancéreuse, peut se former à partir de cellules glandulaires, musculaires, nerveuses, adipeuses... La dénomination d’un cancer varie en fonction de la cellule d’origine. On distingue :
- le carcinome : La maladie apparaît dans un épithélium, c’est-à-dire dans un tissu recouvrant les surfaces internes (tissu de revêtement des organes) ou externes (épiderme par exemple).
- le sarcome : La maladie naît dans un tissu de support (les os par exemple).
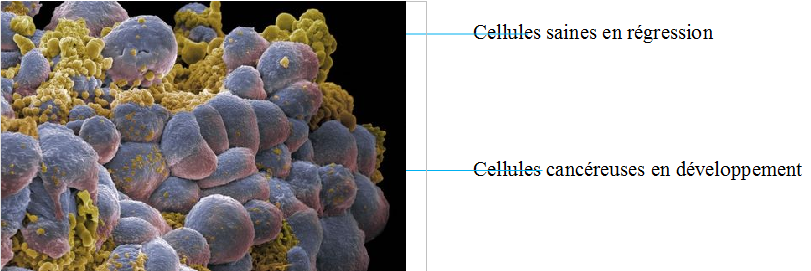
La cancérisation survient à la suite de mutations de l’ADN liées à des substances toxiques ingérées, respirées, touchées, à des rayonnements ionisants, des agents infectieux (virus) ….
Les cellules cancéreuses dérivent toutes d’un même clone, cellule initiatrice du cancer. Ces cellules vont alors perdre leur fonction d’origine et se diviser de façon incontrôlée.
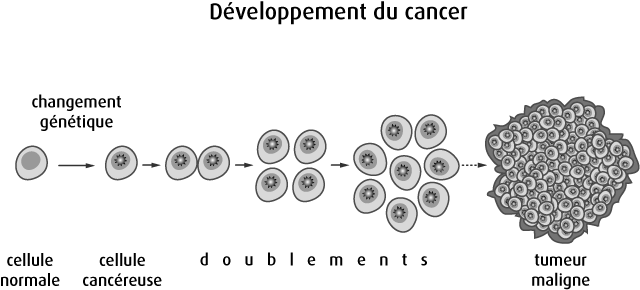
Leur architecture va se modifier. Leur noyau va changer de forme et de taille.
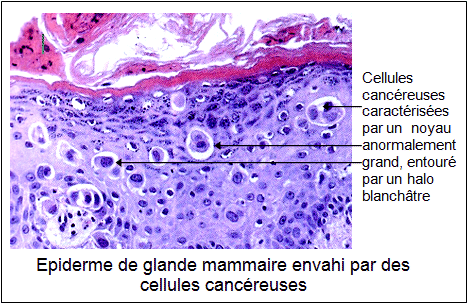
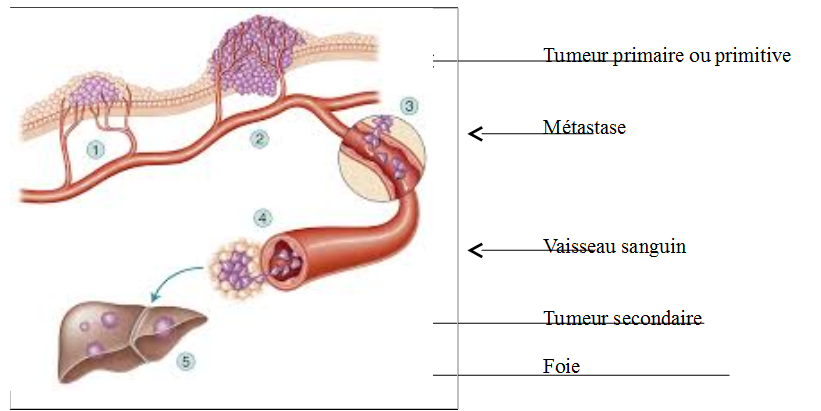
En outre, ces cellules cancéreuses vont également produire des protéines particulières. Elles provoquent la formation de nouveaux vaisseaux sanguins qui permettent d’irriguer la tumeur. Ce phénomène est indispensable à leur développement. De plus, dans leur environnement proche, les cellules cancéreuses ont la capacité de détourner le fonctionnement des cellules saines à leur avantage. Enfin, une dernière propriété caractérise certaines cellules cancéreuses qui ont la capacité de se détacher de la tumeur « mère » : ce sont les métastases. Ces dernières peuvent ensuite envahir d’autres tissus d’autres organes par l’intermédiaire de la lymphe ou du sang. A leur tour, elles engendreront malheureusement d’autres cancers qualifiés de secondaires.
2) Protocole et sécurité
D’après les indications données par l’IRSN, institut de radioprotection et de sûreté nucléaire, l’efficacité d’un traitement par radiothérapie dépend du choix de la technique de traitement. Pour l’évaluer, il faut tenir compte :
- de la dose nécessaire au contrôle de la tumeur,
- de la dose de tolérance des tissus sains irradiés,
- de la nature des complications qui peuvent survenir et de leurs conséquences.
L’étude des effets biologiques des rayonnements ionisants montre que tout sous dosage au-delà de 5% accroit les risques de récidive du cancer alors qu’un surdosage supérieur à 5 % est susceptible d’entraîner des effets secondaires sévères. Cette pratique médicale requière donc une approche pluridisciplinaire et impose donc une prise de risque calculé par l’ensemble des différents acteurs d’un service de radiothérapie.
Ainsi, la notion d’équilibre bénéfice/risque repose donc sur le compromis entre l’efficacité maximale du contrôle tumoral et la minimisation des dommages aux tissus sains.
Le CEA, commissariat à l’énergie atomique, recommande de suivre un protocole de radiothérapie qui s’appuie sur :
- l’établissement « d’une carte d’identité de la tumeur » : type, localisation, taille, extension, tissus infiltrés, stade de développement, présence de métastases…
- le choix de la radiothérapie retenue pour le traitement, seule ou associée (chirurgie, chimiothérapie…). Ce choix concerté appartient à un médecin oncologue (cancérologue) et à un médecin radiothérapeute.
- - l’évaluation d’une dose totale de radiation nécessaire au contrôle de la tumeur. Le protocole devra détailler le fractionnement de cette dose, le nombre de séances et leurs fréquences.
- - les soins, le suivi et l’accompagnement médical du patient.
Une radiothérapie classique prévoit par exemple de délivrer la dose totale par fraction de 2 Gy (gray), une fois par jour pendant 5 jours par semaine. Ce fractionnement et cette répartition permettent d’obtenir un très bon rapport entre l’efficacité anti-tumorale et la tolérance des tissus sains. Il est important de rappeler que cet étalement offre la possibilité aux tissus sains irradiés de se régénérer entre chaque séance et ce, plus rapidement que les cellules cancéreuses.
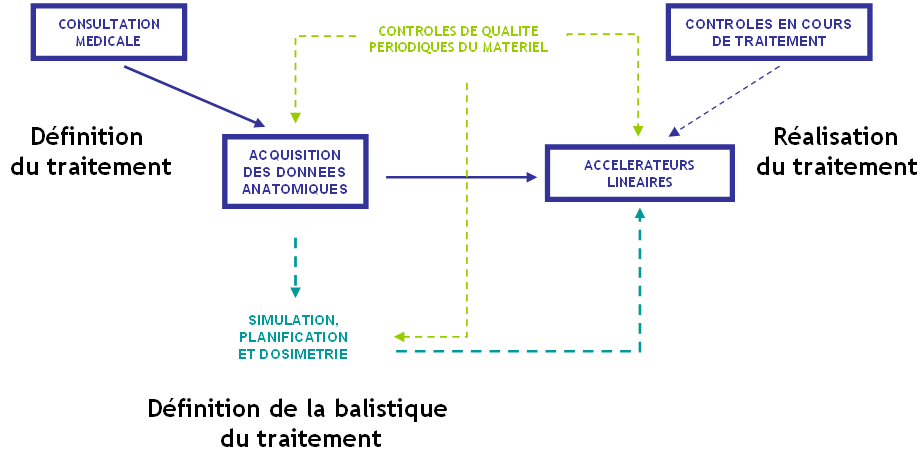
- en bleu foncé : parcours du patient
- en vert clair et bleu clair : tâches réalisées par le radiothérapeute, le radiophysicien et les techniciens
- en vert clair : contrôles de qualité périodiques réalisés sous la responsabilité du radiophysicien
Remarque : La balistique du traitement est planifiée et validée par un radiophysicien. Cette étude précise le choix du nombre de faisceaux, leurs caractéristiques (orientation, énergie, taille des champs…).
3) Des techniques à la pointe de la technologie
► La radiothérapie conformationnelle 3D
C’est la technique de radiothérapie externe la plus communément utilisée aujourd’hui. De plus, tous les centres de radiothérapie sont équipés pour la pratiquer.
Cette technique permet de faire correspondre le plus précisément possible (conformer) le volume de la tumeur cible au volume irradié. Pour se faire, elle utilise des images en 3 dimensions de la tumeur et des organes avoisinants obtenues par scanner, IRM…
Ces technologies sont également équipées de logiciels qui permettent de simuler virtuellement les faisceaux d’irradiation sur la zone cible et la distribution des doses programmées. Cela permet de corriger ou réajuster certains faisceaux afin de limiter au maximum l’exposition des tissus sains.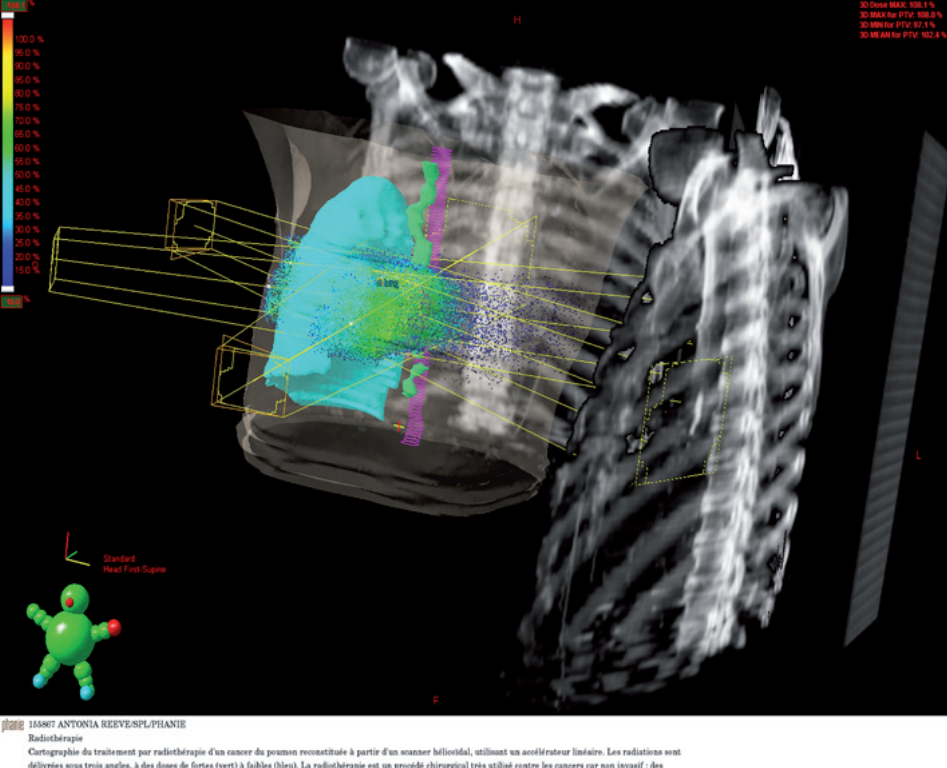
►Le système « Cyberknife »
C’est un système qui utilise la robotique pour traiter des tumeurs dans tout le corps et dont la localisation n’autorise pas le recours à une radiothérapie conformationnelle ordinaire. L'association des techniques de guidage par imagerie médicale et de la robotique assistée par ordinateur permet de délivrer avec une précision submillimétrique, de multiples faisceaux en direction de la tumeur. Ce fractionnement et cette répartition plus uniforme des radiations permettent de déconcentrer les effets secondaires sur les tissus sains sensibles sans réduire l’irradiation des cellules cibles cancéreuses. Par ailleurs, ce système permet de corriger les positions et les mouvements du patient pendant le traitement.
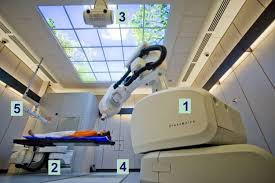
- bras articulé délivrant les radiations
- table orientable
- rayons X contrôlant la position du patient
- détecteurs de silicium au sol
- caméra de synchronisation
4) Effets secondaires liés à une radiothérapie
L’IRSN s’efforce de mieux cerner l’apparition et l’évolution des séquelles liées à une radiothérapie. Ses recherches visent aussi à améliorer l’évaluation de la dose reçue à proximité de la région traitée, en particulier quand les faisceaux de rayonnement sont proches d’un organe sensible (cœur par exemple).
Les effets secondaires des radiothérapies ont été classés en dommages aigus et tardifs. La toxicité aigüe regroupe les conséquences qui se font ressentir dans les quelques jours après le traitement et jusqu’à 6 mois après, tandis que la toxicité tardive regroupe les effets secondaires qui apparaîtront entre 6 mois et 30 ans après la fin de l’irradiation. L’anticipation de ces derniers reste très complexe. D’autre part, on pourrait penser qu’il existe un lien entre des atteintes aigües graves et le développement de séquelles tardives. Or, ce lien de causalité n’a toujours pas été démontré formellement.
Les effets secondaires diffèrent largement d’une personne à l’autre selon la localisation et le volume irradié, la dose délivrée, la radiosensibilité individuelle du patient et son état général.
► Les effets secondaires aigus ou précoces :
- Une fatigue physique et morale
- Des troubles sexuels et une perte de fertilité peuvent survenir lors du traitement de certains cancers (ovaires, utérus, prostate, testicules…). Pour pallier ces problèmes, des prélèvements d’ovocytes ou de sperme peuvent être envisagées avant le traitement afin qu’ils soient conservés.
- Une réaction inflammatoire : un gonflement de la région irradiée (appelé oedème) peut apparaître en cours de traitement.
- Des effets sur le sang : activation du système de coagulation, diminution de la production de cellules sanguines (lymphocytes et hématies) lorsque les cellules souches de la moelle osseuse, lieu de production, sont touchées. Cela peut survenir lors d’une irradiation large du thorax. La diminution des lymphocytes affaiblit le système immunitaire du patient et le rend plus vulnérable.
- Des brûlures de la peau au niveau de la zone irradiée. Elles apparaissent sous forme de rougeurs (érythèmes).
Certains troubles ou séquelles apparaissent spécifiquement dans le traitement de certaines zones :
- Une radiothérapie de la tête ou du cerveau peut s’accompagner de maux de tête, de nausées, de vomissements, d’une chute des cheveux, des cils et des sourcils.
- Une radiothérapie du thorax peut assécher et irriter l’œsophage et la trachée. Ce qui engendre des gênes et des douleurs pour manger, avaler…
- Lorsque le ventre et le bas-ventre sont irradiés, des douleurs, des nausées, des vomissements, des diarrhées, des inflammations tube digestif (intestin)…peuvent survenir. Des troubles sexuels peuvent également être rencontrés. Chez la femme, l’irradiation assèche les muqueuses génitales, ce qui rend les rapports douloureux. Chez l’homme, des troubles de l’érection et de l’éjaculation peuvent être observés.
► Les effets secondaires tardifs :
La sévérité des effets tissulaires est principalement due à la perte cellulaire par mort radio-induite ayant pour conséquence une déficience fonctionnelle de l’organe acquise avec le temps.
Les effets secondaires tardifs varient également en fonction de la personne et de la zone traitée.
Parmi eux, on peut citer :
- Une perte d’élasticité de la peau. D’autres pathologies peuvent être associées : dilatation superficielle des vaisseaux sanguins (couperose), radiosensibilité acquise et nécessité de se protéger du soleil…
- Baisse ou absence de sécrétion de salive.
- Des inflammations douloureuses et chroniques.
- Troubles digestifs et maux de ventres
- Troubles sexuels et rapports douloureux lorsque les muqueuses sont touchées.
- Stérilité
- Perte définitive des cheveux
- Fibroses : tissu fibreux qui se développe dans le milieu interstitiel (entre les cellules) à la suite de destructions, de lésions. Cette maladie peut évoluer et s’avérer invasive. Les cellules saines se trouvent alors enserrer et progressivement détruites. La fibrose peut toucher des organes vitaux tels que le foie, les poumons…
► Quelques contre-indications pendant une radiothérapie :
- Proscrire un projet de grossesse. Le fœtus est très sensible aux radiations.
- Ne pas exposer au soleil des zones irradiées.
- Contrôler la prise de médicaments radiosensibilisants.
5) De nouvelles pistes
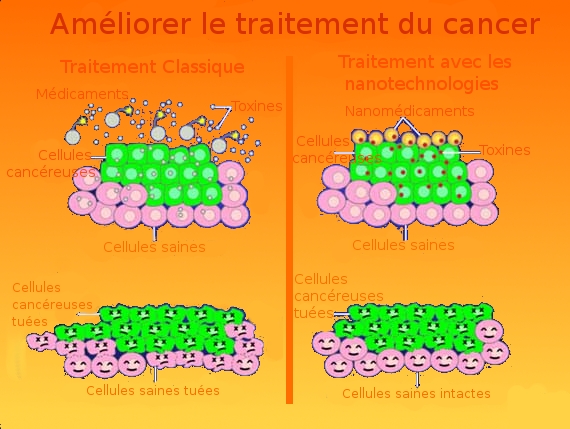
► L’utilisation de nanoparticules :
Une autre voie est aujourd’hui explorée. Pour amplifier l’effet destructeur d’un rayonnement, des chercheurs ont eu l’idée d’injecter des nanoparticules cristallines et inorganiques d’oxyde d’hafnium (HfO2) d’un diamètre de 50 nm, dans des cellules cancéreuses. Ces premières nanoparticules NBTXR3 ont la propriété d’émettre des quantités importantes d’électrons lorsqu’elles sont soumises à des rayons X, sans entraîner de réactions inflammatoires douloureuses. Les réactions en chaîne observées démultiplient alors la formation de radicaux libres et augmentent considérablement le pouvoir de destruction du rayonnement. Les premiers essais cliniques sur l’humain sont en cours de réalisation.
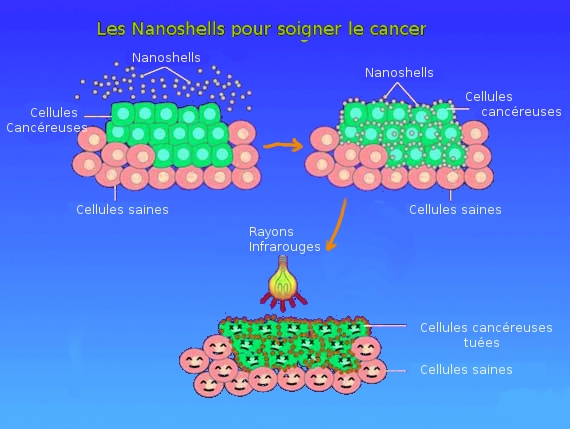
Une variante de cette technologie existe avec les nanoshells (nanocoquilles), minuscules billes recouvertes d'or. Celles-ci ont la particularité d’absorber des longueurs d'ondes proches des infrarouges. Ce qui produit une intense chaleur. Ainsi, en exposant des cellules cancéreuses contenant ces nanoshells à des rayons infra-rouges, une destruction cellulaire s’opère par la chaleur absorbée.
► L’utilisation de molécules associées à la radiothérapie :
Certains médicaments de chimiothérapie peuvent être donnés en même temps qu’une radiothérapie, car ils rendent les cellules cancéreuses plus sensibles aux rayons et augmentent ainsi leur efficacité. On parle de radiosensibilisation ou de médicaments radiosensibilisants. Cette association, qu’on appelle radiochimiothérapie concomitante, est particulièrement utilisée dans le traitement des cancers bronchiques. De nombreuses recherches sont actuellement en cours.
D’autres médicaments tels que les molécules Dbait, découvertes par des chercheurs de l’institut Curie, empêchent les cellules de réparer leur ADN après une irradiation. Ces molécules imitent l’apparence d’un brin d’ADN cassé.

Lorsqu’elles sont introduites dans les cellules cancéreuses, ces molécules vont leurrer et donc mobiliser les complexes enzymatiques de réparation de l’ADN. Leur grand nombre va ainsi les saturer, empêchant toute réparation des véritables brins d’ADN altérés.
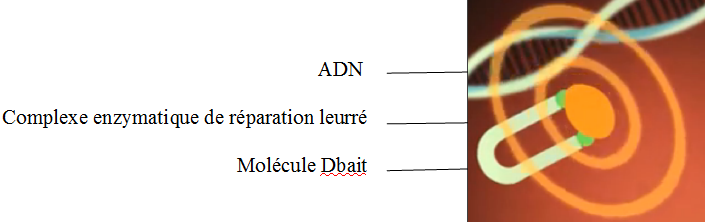
Cette association thérapeutique rend ainsi sensibles des cellules cancéreuses qui jusque-là étaient résistantes aux traitements classiques.